De Stamcel blijft bescheiden
Het
is duidelijk dat vandaag de dag niet iedereen even enthousiast
is over de vorderingen van het stamcelonderzoek. Zolang
de experimenten zich beperkten tot ratten en muizen
was er geen vuiltje aan de lucht. Maar de fameuze doorbraken
bij proefdieren hebben wereldwijd het verlangen gewekt
de successen met menselijke stamcellen te herhalen.
Dat is echter niet zo eenvoudig. Aangezien het onderzoek
zich in eerste plaats richt op embryonaal weefsel, staat
dit voor veel mensen gelijk aan moord.
 In
de Verenigde staten, de bakermat van het stamcelonderzoek,
leek het er zelfs even alsof op dat president Bush de tegenstanders
hun zin wilde geven en de universiteiten geen rechten meer te verlenen. De medische wereld ging in het verweer met
een nog nooit eerder vertoond media-offensief. Ook de
Europese pers liet zich niet onbetuigd. Kranten en tijdschriften
overspoelden ons met veelbelovende resultaten, nieuwe
ontdekkingen en geslaagde experimenten. Op 9 augustus
2001 volgde een zucht van verlichting: Bush toonde zich
bereid verder onderzoek op bestaande stamcellijnen -
over de hele wereld zijn er vierenzestig erkend door
de Amerikaanse National institutes of Health - met belastinggeld te sponsoren. "De keuze tussen leven en dood is
daar al genomen", verantwoordde de president zijn beslissing.
Van in- vitro fertilisatie overgebleven embryo's gebruiken
om er vers materiaal uit te "oogsten" was
daarentegen ging brug te ver en het actief creëren van
embryo's voor onderzoek botste al helemaal op een presidentieel
"no". Ondanks het achterpoortje - het verbod
geldt alleen voor onderzoek dat wordt gefinancierd met
overheidsgeld - reageerden tal van wetenschappers ontgoocheld.
Het razende tempo waarmee de puzzelstukjes worden blootgelegd,
geeft velen de indruk dat het onderzoek vergevorderd
is. Maar wanneer stamcellen hun therapeutische beloften
kunnen inlossen, is nog veel onderzoek nodig, heel veel
onderzoek. En daar hoort bijgevolg ook nog heel veel onderzoeksmateriaal bij.
In
de Verenigde staten, de bakermat van het stamcelonderzoek,
leek het er zelfs even alsof op dat president Bush de tegenstanders
hun zin wilde geven en de universiteiten geen rechten meer te verlenen. De medische wereld ging in het verweer met
een nog nooit eerder vertoond media-offensief. Ook de
Europese pers liet zich niet onbetuigd. Kranten en tijdschriften
overspoelden ons met veelbelovende resultaten, nieuwe
ontdekkingen en geslaagde experimenten. Op 9 augustus
2001 volgde een zucht van verlichting: Bush toonde zich
bereid verder onderzoek op bestaande stamcellijnen -
over de hele wereld zijn er vierenzestig erkend door
de Amerikaanse National institutes of Health - met belastinggeld te sponsoren. "De keuze tussen leven en dood is
daar al genomen", verantwoordde de president zijn beslissing.
Van in- vitro fertilisatie overgebleven embryo's gebruiken
om er vers materiaal uit te "oogsten" was
daarentegen ging brug te ver en het actief creëren van
embryo's voor onderzoek botste al helemaal op een presidentieel
"no". Ondanks het achterpoortje - het verbod
geldt alleen voor onderzoek dat wordt gefinancierd met
overheidsgeld - reageerden tal van wetenschappers ontgoocheld.
Het razende tempo waarmee de puzzelstukjes worden blootgelegd,
geeft velen de indruk dat het onderzoek vergevorderd
is. Maar wanneer stamcellen hun therapeutische beloften
kunnen inlossen, is nog veel onderzoek nodig, heel veel
onderzoek. En daar hoort bijgevolg ook nog heel veel onderzoeksmateriaal bij.
Ambitieuze
plannen
De
stamcellen beloven ons wel grootse dingen. Vanuit een
kweekschaaltje zullen ze eropuit gestuurd kunnen worden
om beschadigde weefsels te repareren. Bijvoorbeeld naar
de substantia nigra in de hersenen om er de vernietigende
effecten van de Ziekte van Parkinson op het brein terug
te draaien. De vele patiënten met diabetes type I zouden
in plaats van de steeds weerkerende insulinespuit kunnen
kiezen voor een enkele stamcelinjectie. En na een hartinfarct
zouden de ingespoten reparatiecellen de beschadigde
motor kunnen oplappen. Wachten op donororganen zal tot
het verleden behoren. Ook ruggenmergletsels zullen na
een injectie met de wondercellen spontaan herstellen.
En klaag dan vooral niet meer over een akkefietje als
reumatoïde artritis, maar laat u behandelen met uw eigen
genetisch gemodificeerde stamcellen. Het klinkt geweldig,
alleen zijn we in de praktijk nog lang niet zo ver.
De ambitieuze plannen zijn ingegeven door twee bijzondere
eigenschappen van stamcellen. Een eerste is hun vermogen
om zich tot elk celtype van het lichaam om te vormen.
Wanneer we ons lichaam vergelijken met een fabriek,
dan mogen we rustig stellen dat daar een niveau van
arbeidsverdeling wordt bereikt waar menig manager wat
van kan leren. De meer dan tweehonderd soorten somatische
cellen kwijten zich allen met overgave van hun specifieke
taak. Om die zo goed mogelijk uit te voeren, heeft elke
soort maar een klein deeltje van het erfelijk materiaal,
het DNA, nodig en brengt hij een eigen selectie van genen
tot uitdrukking. Het ongebruikte deel van het DNA wordt
in de kern geblokkeerd. Dit proces noemen we differentiatie.
Zodra een cel een beroepskeuze heeft gemaakt, zal hij
zich daar gedurende zijn hele carrière aan houden. een
stamcel lijkt daarentegen meer op de eeuwige student:
hij schuift de beslissing voor zich uit en houdt alle
opties open.
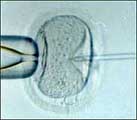 Een
gedifferentieerde cel vermenigvuldigt zich zelden of
niet. Wanneer een orgaan door ziekte of ongeval beschadigd
raakt, kunnen gespecialiseerde lichaamscellen het dode
of aangetaste weefsel niet goed vervangen. Dat brengt
ons bij de tweede bijzondere eigenschap. Stamcellen
kunnen praktisch onbeperkt dochtercellen vormen of "prolifereren".
Bij elke deling zal minstens één cel een nieuwe stamcel
zijn, zodat het voortbestaan is verzekerd. Met andere woorden: stamcellen
kunnen zichzelf met andere woorden vernieuwen. De tweede
dochtercel kan een partieel gedifferentieerde voorlopercel
zijn, die via een reeks delingsstappen tot specifieke
celtypes zal leiden. Daarna valt het delen stil. Proliferatie
en differentiatie zijn het begin- en eindpunt van een
proces dat van een stamcel tot lichaamcel leidt.
Een
gedifferentieerde cel vermenigvuldigt zich zelden of
niet. Wanneer een orgaan door ziekte of ongeval beschadigd
raakt, kunnen gespecialiseerde lichaamscellen het dode
of aangetaste weefsel niet goed vervangen. Dat brengt
ons bij de tweede bijzondere eigenschap. Stamcellen
kunnen praktisch onbeperkt dochtercellen vormen of "prolifereren".
Bij elke deling zal minstens één cel een nieuwe stamcel
zijn, zodat het voortbestaan is verzekerd. Met andere woorden: stamcellen
kunnen zichzelf met andere woorden vernieuwen. De tweede
dochtercel kan een partieel gedifferentieerde voorlopercel
zijn, die via een reeks delingsstappen tot specifieke
celtypes zal leiden. Daarna valt het delen stil. Proliferatie
en differentiatie zijn het begin- en eindpunt van een
proces dat van een stamcel tot lichaamcel leidt.
Wetenschappers
hopen nu van de neiging tot prolifereren gebruik te
maken om in vitro grote hoeveelheden stamcellen aan
te maken. Om transplantaties uit te voeren of organen
te herstellen zijn nu eenmaal veel cellen nodig. Wanneer
een voldoende grote hoeveelheid is aangelegd, kunnen
de stamcellen worden aangestuurd om in de gewenste richting
te differentiëren, bijvoorbeeld tot de voorlopers van
hartcellen. In het lichaam van de patiënt zullen de
cellen naar het beschadigde orgaan migreren. In dit
geval naar het hart, waar ze de plaats innemen van de
hartspiercellen die na een infarct zijn afgestorven.
Een
mens is geen muis
De
medische wetenschap bestudeert de bijzondere eigenschappen
van embryonale stamcellen, kortweg ES, al twintig jaar
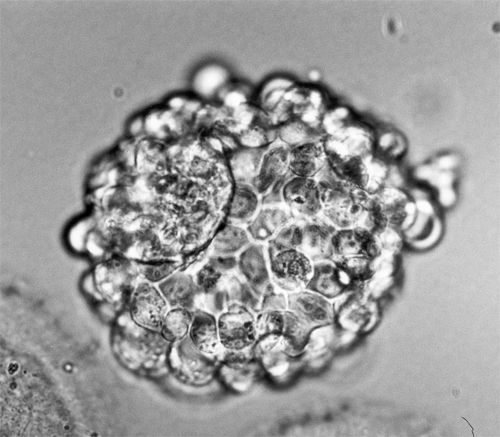
bij proefdieren. ES uit muis-blastocysten, holle celclusters
die kort na de bevruchting ontstaan, konden in vitro
tot tien miljard dochtercellen worden vermeerderd. Om
de proliferatie in stand te houden, moet wel de leukemie
inhibitorische factor of LIF, een agens dat differentiatie
tegengaat, aan het cultuurmedium worden toegevoegd.
In de loop der jaren konden diverse onderzoeksteams
allerlei lichaamcellen uit de muizenstamcellen genereren,
waaronder de voorlopercellen van bloedvaten, voor dopamine
en serotonine gevoelige neuronen en hormoonsecreterende
pancreascellen. Maar een mens is geen muis en niets garandeert dat humane
stamcellen zich op gelijkwaardige manier zullen gedragen.
Zo schijnen ze zich alvast weinig aan te trekken van
de aanwezigheid in het cultuurmedium van LIF. Ook de
moleculen die ze op het celmembraan dragen en die worden
gebruikt om maagdelijke, ongedifferentieerde cellen
te herkennen, verschillen duidelijk van de merkers die
"naïeve" muizencellen tot expressie brengen
en de in vitro groei verloopt een stuk moeizamer. Het
duurde tot 1998 vooraleer Science het heuglijke nieuws
mocht publiceren dat dr James Thomson van de University
of Wisconson er als eerste in was geslaagd humane embryonale
stamcellen (hes) te isoleren en in cultuur te brengen.
Zijn onderzoeksteam haalde de cellen uit de embryo's
die waren gecreëerd om onvruchtbare paren aan kinderen
te helpen. Zesendertig verse en ingevroren rest-embryo's
leidden uiteindelijk tot vijf cellijnen. In de loop
van de voorbije twee jaren deelden die allereerste hes
vele honderden keren en genereerden in vitro miljoenen
dochtercellen. Daarmee doen ze hun reputatie van zelfvernieuwende
cellen alle eer aan.
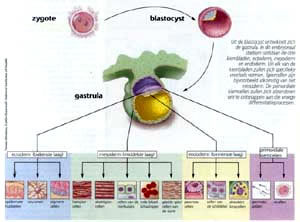
Pluripotentie aangetoond
 Inmiddels
leverden onderzoekers de bewijzen dat humane ES zich
net, als de ES uit muizen, kunnen differentiëren tot
gespecialiseerde cellen van zowel ecto-, endo- als mesodermale
oorsprong (de drie kiembladen) , een eigenschap die
doorgaans wordt aangeduid als pluripotentie. Wanneer
hes in de testes van laboratoriummuizen worden geïnjecteerd,
groeien ze uit tot teratoma's, goedaardige gezwellen
die de meest diverse weefsels bevatten, zoals (kraak)been,
spiercellen, neuronen, bloedvaten en zelfs tandweefsel
of haren, wat een vrij grotesk amalgaam oplevert. Ook
in vitro differentiëren de hes - na verwijdering van
de speciale "voedercellen" die proliferatie
in laboratoriumomstandigheden gaande houden - spontaan
uit tot meerdere weefseltypes.
Inmiddels
leverden onderzoekers de bewijzen dat humane ES zich
net, als de ES uit muizen, kunnen differentiëren tot
gespecialiseerde cellen van zowel ecto-, endo- als mesodermale
oorsprong (de drie kiembladen) , een eigenschap die
doorgaans wordt aangeduid als pluripotentie. Wanneer
hes in de testes van laboratoriummuizen worden geïnjecteerd,
groeien ze uit tot teratoma's, goedaardige gezwellen
die de meest diverse weefsels bevatten, zoals (kraak)been,
spiercellen, neuronen, bloedvaten en zelfs tandweefsel
of haren, wat een vrij grotesk amalgaam oplevert. Ook
in vitro differentiëren de hes - na verwijdering van
de speciale "voedercellen" die proliferatie
in laboratoriumomstandigheden gaande houden - spontaan
uit tot meerdere weefseltypes.
In hetzelfde jaar als Thomson boorde dr John Gearhart
van de John Hopkins University op succesvolle wijze
een tweede bron van pluripotente stamcellen aan. Hij
nam de primordiale kiemcellen, de voorlopers van de
geslachtscellen, weg uit geaborteerde foetussen van vijf
a negen weken oud. Ofschoon de vorming van alle weefseltypes
niet in vitro kon worden bewezen - de cellen vormen
na injectie bij muizen geen teratoma's - tonen ook deze
zogenamde embryonic germ cells of EG zich in vitro bijzonder flexibel.
Net als de ES kunnen ze cellen uit de drie kiembladen
vormen en mogen ze dus pluripotent worden genoemd. Ook
al zijn hun differentiatiemogelijkheden gereduceerd.
Ze beschikken immers niet langer over de volledige waaier
aan chemische modificatiemechanismen die ES gebruiken
om genen te (de-)blokkeren. Ook hun mogelijkheden tot
proliferatie zijn enigszins beperkt. Ze delen geen honderden
keren, maar vermeerderen maximaal zeventig tot tachtig
keer.
In
vitro kunnen de hes en heg worden geïnduceerd om uit
te groeien tot zogenaamde embryonale lichaampjes, celclusters
die voorlopercellen bevatten van alle mogelijke weefseltypes,
maar waarvan de precieze samenstelling zich moeilijk
laat voorspellen. De differentiatiemogelijkheden van
de ES en EG zijn natuurlijk pas interessant als ze kunnen
worden gestuurd. Dit wil nu al lukken voor insuline-
producerende pancreascellen, contractiele hartspiercellen
en bloedcellen. De uitdagingen blijven echter groot.
De cellen moeten het juiste evenwicht vinden tussen
proliferatie en differentiatie. Uiterlijke kenmerken
van de gespecialiseerde cellen volstaan bovendien niet
om een opgelegde differentiatie geslaagd te noemen.
De eindproducten moeten in vitro ook echt functioneel
worden. Voor insuline-secreterende cellen betekent dit
dat ze de vrijgemaakte insuline niet zomaar mogen vrijgeven,
maar dat moet dan op basis van het in het bloed geregistreerde
glucosegehalte. Hoewel
onderzoekers al heel veel met groeifactoren hebben geëxperimenteerd,
blijft een zweem van mysterie hangen rond de precieze
mechanismen die de stamcellen in een bepaalde richting
sturen. Vaak wordt het aan de natuur overgelaten om
de juiste signalen te geven. Het genereren van hartcellen
bijvoorbeeld kan gedaan worden door hes in cultuur te brengen in aanwezigheid
van muis-blastocysten, de voorlopers van hartcellen.
Er werd immers al meermaals geconstateerd dat de omgeving
waarin een cel terechtkomt bepalend is voor de gekozen
differentiatierichting.
Voorraadje volwassen stamcellen
Sinds
de overschakeling van proeven met dieren naar experimenten
op menselijke embryonale stamcellen, zijn er misschien
wel even veel artikelen gepubliceerd  over de ethische
implicaties van het onderzoek als over de bevindingen
van de wetenschappers zelf. Het idee dat de wetenschap
beginnend menselijk leven uit elkaar peutert alsof
het kikkerdril was,bezorgt heel wat mensen acute buikpijn.Het debat wordt dan ook gevoerd op het scherp van de
snede.Nu blijkt dat ook volwassen mensen in vrijwel
elk orgaan een voorraadje stamcellen hebben,
gaan meer en meer stemmen op om het onderzoek toe te
splitsen op de zogenaamde adulte stamcellen of AS.
over de ethische
implicaties van het onderzoek als over de bevindingen
van de wetenschappers zelf. Het idee dat de wetenschap
beginnend menselijk leven uit elkaar peutert alsof
het kikkerdril was,bezorgt heel wat mensen acute buikpijn.Het debat wordt dan ook gevoerd op het scherp van de
snede.Nu blijkt dat ook volwassen mensen in vrijwel
elk orgaan een voorraadje stamcellen hebben,
gaan meer en meer stemmen op om het onderzoek toe te
splitsen op de zogenaamde adulte stamcellen of AS.
Drie
tot vier dagen na de bevruchting
Het
gebruik van stamcellen is eigenlijk niet nieuw. Ze
worden al meer dan veertig jaar gebruikt in beenmergtransplantaties,
waarbij ze vanzelf naar het bot van de ontvanger migreren.
Van daaruit kunnen ze de levensnoodzakelijke bloedcelvorming
herstellen. De stamcellen uit het beenmerg vormen
de rode bloedlichaampjes, de verschillende types witte
bloedlichaampjes en de bloedplaatjes. We noemen ze
daarom multipotent. Ze kunnen tot een aantal celtypes differentiëren,
maar ze beperken zich wel tot dat ene orgaan waar
ze thuishoren.
Hoewel
niet altijd even onomstotelijk, werd ook in andere
organen de aanwezigheid van AS aangetoond, zoals
in de pancreas, de lever, de skeletspieren, de huid,
het oog en het gebit. Zelfs in de hersenen, waarvan
lang gedacht werd dat ze niet tot regeneratie in staat
waren, verschuilen zich ongedifferentieerde cellen
die na ontvangst van de juiste signalen kunnen uitgroeien
tot de verschillende componenten van het brein (neuronen,
oligodendrocyten en astrocyten). De waarschuwing dat
je na een avondje flink doorzakken door verlies van
hersencellen voorgoed aan IQ- hoogte hebt ingeboet,
berust dus gelukkig op een misverstand
De
interesse voor adulte stamcellen nam pas de huidige
proporties aan toen bleek dat ook zij met de nodige
aansporingen in zeer uiteenlopende richtingen kunnen
differentiëren. AS in beenmerg en in hersencellen
zijn het best gekarakteriseerd. Stamcellen uit de
hersenen, die van neuro-ectodermale oorsprong zijn,
blijken zich te kunnen ompolen tot bloed- of spiercellen,
beide afkomstig van het mesodermale kiemblad. Stamcellen
uit het beenmerg leggen even gemakkelijk de weg af
tot neurale, spier- en levercellen. Tot nu toe zijn
geen AS bekend die weefsels uit alle drie de kiembladen
kunnen vormen en dus pluripotent zijn
Beenmerg
bevat bijvoorbeeld naast de hematopoietische stamcellen
ook stromale stamcellen, die de bouwstenen produceren
voor de bloedvaten en waarvan al werd aangetoond dat
ze zich omvormen tot kraakbeen-, gladde spier- en vetcellen.
Wanneer onderzoekers uit neurale stamcellen bloedcellen
doen ontstaan, moeten ze onomstotelijk kunnen aantonen
dat die niet het resultaat zijn van een verdwaalde
hematopoetische stamcel. Dat kan alleen door klonen.
Wij hebben het hier niet over Dolly en consorten,
maar over de techniek waarbij door deling een heleboel
identieke cellen worden gemaakt uit een individuele
cel. Lang niet alle studies leveren die bewijzen of
tonen aan dat de gedifferentieerde cellen werkelijk
functioneel zijn. In een aantal experimenten lukte
dat wel, onder andere in een experiment waarbij beenmergcellen
van een mannelijke muis werden in gespoten bij een
wijfje met een leverdefect. De zieke vrouwtjesmuis
genas. Gelijkwaardige resultaten zijn ook al behaald
bij de mens. Op dezelfde manier werd ontdekt dat neurale
stamcellen die in de spieren van mensen en muizen
werden gespoten, tot functionele spiercellen kunnen
uitgroeien.
 Stamcellen
migreren uit zichzelf naar de plaats waar hun hulp
nodig is. Ze drijven met de bloedstroom mee en "leggen
aan" op die plaatsen in het lichaam waar ze receptoren
vinden voor de specifieke moleculen in hun celmembraan.
Voorlopig moeten we nog raden naar de exacte identiteit
van de factoren die dit proces besturen of beïnvloeden.
Overigens, ook bij beenmergtransplantaties wordt het
bloed gewoon via een infuus toegediend en zoekt
het zelf zijn weg naar het beenmerg.
Stamcellen
migreren uit zichzelf naar de plaats waar hun hulp
nodig is. Ze drijven met de bloedstroom mee en "leggen
aan" op die plaatsen in het lichaam waar ze receptoren
vinden voor de specifieke moleculen in hun celmembraan.
Voorlopig moeten we nog raden naar de exacte identiteit
van de factoren die dit proces besturen of beïnvloeden.
Overigens, ook bij beenmergtransplantaties wordt het
bloed gewoon via een infuus toegediend en zoekt
het zelf zijn weg naar het beenmerg.
Volwassen
stamcellen of AS zijn moeilijk te herkennen, te isoleren
en in vitro te vermeerderen. Ze stoppen snel met delen
om zich meteen te specialiseren tot de celtypes waarvoor
ze voorbeschikt zijn. Zelfs de hyperactieve beenmergcellen
laten het in een kweekschaaltje afweten. De aantallen
waarvan als basis kan worden uitgegaan, zijn ook al niet groot.
In het beenmerg laat slechts één op de tien tien à vijftienduizend cellen zich als een stamcel herkennen.
Een
tweede mogelijke oplossing waar geen ongeboren leven
aan te pas komt en die volop wordt bestudeerd, is het
gebruik van navelstrengbloed, dat onmiddellijk na de
geboorte uit de doorgeknipte navelstreng wordt gewonnen
en relatief veel stamcellen bevat. Onderzoekers vermoeden
dat deze cellen nog meer differentiatierichtingen kunnen
inslaan dan de adulte stamcellen, maar voorlopig wil
het kweken niet goed lukken.
Doordat
ze nog altijd niet hebben achterhaald waar deze AS
precies vandaan komen, blijven wetenschappers dromen
van de universele stamcel, die - als hij al bestaat
- waarschijnlijk in de bloedstroom te vinden is. De
vaststelling dat AS zich in de verschillende organen
bij voorkeur in de buurt van een bloedvat nestelen,
versterkt dit vermoeden. Toch zijn er aanzienlijke
verschillen tussen de AS in de diverse organen. In
het beenmerg prolifereren de hematopoetische stamcellen
voortdurend om grote aantallen gedifferentieerde bloedcellen
te kunnen vrijgeven, terwijl de meeste organen daarentegen
rustende stamcellen bevatten.
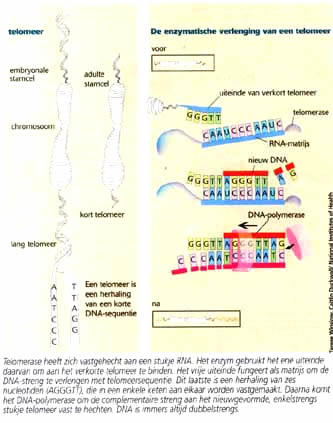 Telomerase
voor eeuwige jeugd Waar embryonale stamcellen
onbeperkt kunnen blijven delen, tonen volwassen of
adulte stamcellen (AS) zich heel wat minder bereidwillig.
Hoe ouder de patiënt, des te moeilijker de AS aan
de praat te krijgen zijn. Gewone lichaamscellen hebben
er al helemaal geen zin meer in. Het verschil zit
hem in de telomeren, repetitieve DNA-sequenties aan
het uiteinde van de chromosomen. Ze bevatten geen
functionele informatie, maar dienen om de DNA-strengen
te beschermen. (klik op het plaatje voor een vergroting.)
Telomerase
voor eeuwige jeugd Waar embryonale stamcellen
onbeperkt kunnen blijven delen, tonen volwassen of
adulte stamcellen (AS) zich heel wat minder bereidwillig.
Hoe ouder de patiënt, des te moeilijker de AS aan
de praat te krijgen zijn. Gewone lichaamscellen hebben
er al helemaal geen zin meer in. Het verschil zit
hem in de telomeren, repetitieve DNA-sequenties aan
het uiteinde van de chromosomen. Ze bevatten geen
functionele informatie, maar dienen om de DNA-strengen
te beschermen. (klik op het plaatje voor een vergroting.)
In
gewone lichaamscellen wordt de telomeersequentie bij
elke deling een stukje korter. Het DNA-polymerase, het
enzym dat instaat voor de verdubbeling van het genetisch
materiaal bij elke celdeling, slaagt er niet in het
laatste stukje van de chromosomen over te schrijven.
Na een groot aantal delingen blijft bijna niets over
van de telomeren, waarna de lichaamscel in delingsrust
gaat of afsterft. Bij verdere delingsrondes zou immers
het essentiële DNA beginnen weg te knabbelen. Cellen
die zich gedurende lange tijd kunnen blijven vermenigvuldigen
en zogenaamd onsterfelijk zijn, behouden hun lange telomeren.
Ze beschikken over een bijkomend enzym, telomerase,
dat na elke deling het verloren stukje repetitief DNA
weer bijmaakt. Hetzelfde enzym maakt het ook kankercellen
mogelijk zich te blijven delen. Hieruit stamt de vrees dat embryonale stamcellen
aanleiding kunnen geven tot de vorming van tumoren vindt
hierin een bijkomend argument. Anderzijds zullen adulte
stamcellen misschien verouderd weefsel vormen. De makers
van Dolly ontdekten dat het schaap twee jaar na de geboorte
eigenlijk al acht lentes telde. Differentiatie van de
zes jaar oude uierkern waaruit Dolly na kerntransplantatie
ontstond, kon de telomeerverkorting niet ongedaan maken.
Wat moeten we ermee?
ES blijken bijzonder ontvankelijk voor genetische modificatie.
De opname van een vreemd gen in het eigen DNA gebeurt
namelijk alleen tijdens celdeling. Een kolfje naar de
hand van de stamcel dus. Ze vormen wellicht het ideale
vehikel voor de introductie van therapeutische genen
in het lichaam. Hierbij denken we vooral aan auto-immuunziektes,
zoals diabetes mellitus type I en reumatoïde artritis. ES die
bijvoorbeeld zijn voorzien van een gen dat codeert voor
bepaalde cytokinebindende eiwitten, zouden ervoor kunnen
zorgen dat de concentratie van deze afweerstimulerende
stoffen in het bloed daalt en de immuunrespons tegen
het eigen weefsel kalmeert. Door zelfvernieuwing zouden
de ES er bovendien in kunnen slagen de remediërende stoffen langdurig vrij te geven. Genetisch gewijzigde
ES kunnen ook heel wat te bieden hebben in de strijd
tegen kanker. Tot voor kort richtte het onderzoek zich
trouwens vooral op deze toepassing.
Waar
menig dokters- en patiëntenhart sneller van gaat kloppen,
is ongetwijfeld de hoop op orgaanreparatie. Niet alleen
ligt daar misschien de oplossing voor het wereldwijde
tekort aan donororganen, maar wellicht kan de onherstelbare
schade aangericht door bijvoorbeeld de ziekte van Parkinson
of Alzheimer er ooit mee worden teruggedraaid. De meest
betrouwbare experimenten die er op wijzen dat stamcellen
geschikt zijn om beschadigde organen te herstellen en
aangetaste functies over te nemen, werden uitgevoerd
op muizen. Daarbij werden typisch menselijke aandoeningen
nagebootst. Het afbinden van één van de kransslagaders
is een beproefde methode om laboratoriumdieren een hartaanval
te bezorgen.
 Het
stimuleren van een complexe motorischeaandoening als
amyotrofische laterale sclerose (ALS), gebeurt door
besmetting met het sindbisvirus dat de motorische voorhoorncellen
in het ruggenmerg vernietigt en de karakteristieke verlammingsverschijnselen
veroorzaakt. Beide toestanden werden al succesvol met
stamcelinjecties behandeld. Ook voor de ziekte van Parkinson
en diabetes mellitus geven proefdierexperimenten hoop op beterschap.
De verworven resultaten zijn op zich wel betekenisvol,
maar mogen niet zomaar naar de mens worden geëxtrapoleerd. Zelfs als de stamcellen uiteindelijk niet aan
al die hooggespannen verwachtingen voor menselijk therapeutisch
gebruik tegemoet kunnen komen, dan nog zullen ze een
aanzienlijke bijdrage kunnen leveren aan het wetenschappelijk
onderzoek. Stamcellen bieden de mogelijkheid het effect
van nieuwe geneesmiddelen rechtstreeks op de doelwitcellen
aan te tonen en om inzicht te verwerven in de verborgen
processen die leiden tot differentiatie en dedifferentiatie
van cellen. Misschien levert dit soort onderzoek uiteindelijk
therapieën op voor tal van aangeboren aandoeningen.
Zo wilde dr. Gearhart niet zozeer de eerste zijn om
stamcellen te kweken uit primordiale kiemcellen, maar
was hij op zoek naar een geschikt instrument om het
syndroom van Down te bestuderen.
Het
stimuleren van een complexe motorischeaandoening als
amyotrofische laterale sclerose (ALS), gebeurt door
besmetting met het sindbisvirus dat de motorische voorhoorncellen
in het ruggenmerg vernietigt en de karakteristieke verlammingsverschijnselen
veroorzaakt. Beide toestanden werden al succesvol met
stamcelinjecties behandeld. Ook voor de ziekte van Parkinson
en diabetes mellitus geven proefdierexperimenten hoop op beterschap.
De verworven resultaten zijn op zich wel betekenisvol,
maar mogen niet zomaar naar de mens worden geëxtrapoleerd. Zelfs als de stamcellen uiteindelijk niet aan
al die hooggespannen verwachtingen voor menselijk therapeutisch
gebruik tegemoet kunnen komen, dan nog zullen ze een
aanzienlijke bijdrage kunnen leveren aan het wetenschappelijk
onderzoek. Stamcellen bieden de mogelijkheid het effect
van nieuwe geneesmiddelen rechtstreeks op de doelwitcellen
aan te tonen en om inzicht te verwerven in de verborgen
processen die leiden tot differentiatie en dedifferentiatie
van cellen. Misschien levert dit soort onderzoek uiteindelijk
therapieën op voor tal van aangeboren aandoeningen.
Zo wilde dr. Gearhart niet zozeer de eerste zijn om
stamcellen te kweken uit primordiale kiemcellen, maar
was hij op zoek naar een geschikt instrument om het
syndroom van Down te bestuderen.
Nog
niet zomaar uit de diepvriezer
We
staan nog ver af van de situatie dat de arts voor elke
mogelijke ziekte of handicap een setje stamcellen uit
de diepvriezer kan vissen. Therapeutisch gebruik is
vandaag de dag hoegenaamd nog niet verantwoord. De neiging
tot zelfvernieuwing die stamcellen zo interessant maakt,
brengt grote risico's mee. Proliferatie en schijnbare
onsterfelijkheid zijn eigenschappen die ook kankercellen
kenmerken. Dat het injecteren van ongedifferentieerde
ES aanleiding kan geven tot de vorming van teratoma's -
ook al zijn dat goed aardige gezwellen- voorspelt weinig
goeds. Misschien verliezen het deze vervelende eigenschap
wel wanneer ze in vitro worden omgevormd tot meer gespecialiseerde
celtypes, maar zolang de onderliggende mechanismen van
het differentiatieproces onvoldoende bekend zijn, zullen
weinig wetenschappers met de hand op het hart durven
zweren dat differentiatie niet spontaan kan optreden.
Het is trouwens niet eens duidelijk welk differentiatieniveau
voor transplantatie het meest geschikt zou zijn.
Net
zoals de gedifferentieerde lichaamscellen, brengen ook
de stamcellen het volledige gamma membraanmoleculen
tot expressie die het immuunsysteem gebruikt om het
onderscheid te maken tussen eigen cellen en cellen die
het als vreemd beschouwt. Deze zogenaamde MHC-moleculen
(majeure histocompabiliteitscomplex) zorgen ervoor dat
lichaam van de patiënt de organen van een niet compatibele
donor afstoot. Transplantatie van stamcellen wordt daarom
meestal getest bij muizen waarvan het immuunsysteem
is lamgelegd.
 Het
therapeutisch gebruik van stamcellen zal pas mogelijk
worden als donor en ontvanger dezelfde MHC-moleculen
tot expressie brengen. Om voor elke patiënt een
compatibele stamcel te vinden zou zijn, moeten duizenden
verschillende stamcellijnen worden aangelegd. Maar de kans
echter dat de publieke opinie daarmee instemt, is
op dit moment behoorlijk klein. Een andere mogelijkheid
bestaat erin de expressie van weefseltypische antigenen
door genetische manipulatie te veranderen of te blokkeren. (klik op het plaatje voor een vergroting.) Eventueel zou op die manier een universele donorstamcel
kunnen worden gecreëerd. Wanneer de patiënt zijn
eigen stamcellen toegediend kan krijgen, doet dit
probleem zich natuurlijk niet voor. Maar omwille van de
geringe proliferatiemogelijkheden vormen AS voorlopig
geen volwaardig alternatief. Daarnaast lijken de differentiatierichtingen veel beperkter en zijn geprepareerde fracties
zelden zuiver. Veilig gebruik van AS impliceert de
aanmaak van zuivere cellijnen door klonen. Dat geldt
niet voor de hemapoetische componenten uit het beenmerg,
die voor transplantatie bruikbaar zijn omdat ze in
het lichaam van de ontvanger hun reguliere functie mogen uitoefenen. De
aanwezigheid van AS in alle organen staat trouwens
nog altijd ter discussie, ondermeer wat de pancreas
betreft. Hier dient de Dolly aanpak zich als mogelijke
oplossing aan. Om het tekort op te lossen probeerden
onderzoekers door middel van kerntransplantatie embryonale
stamcellen te maken uit lichaamscellen van patienten.
Veel moeten we daar voorlopig niet van verwachten.
Gezien de geringe steun die momenteel te vinden is
voor het gebruik van ten dode opgeschreven menselijke
restembryo's, zal het aanmaken van embryo;s voor het
genezen van zieke organen, het zogenamde therapeutisch
klonen, nog wel een tijdlang in de koelkast blijven.
Het klonen van het eerste menselijke embryo voor onderzoeksdoeleinden
belooft de controverse in de Verenigde Staten weer
te doen losbarsten. De recente prestatie van Advanced
Cell Technology Inc (ACT) zou het witte huis er wel
eens toe kunnen aanzetten ook de private onderzoeksinitiatieven
aan banden te leggen.
Het
therapeutisch gebruik van stamcellen zal pas mogelijk
worden als donor en ontvanger dezelfde MHC-moleculen
tot expressie brengen. Om voor elke patiënt een
compatibele stamcel te vinden zou zijn, moeten duizenden
verschillende stamcellijnen worden aangelegd. Maar de kans
echter dat de publieke opinie daarmee instemt, is
op dit moment behoorlijk klein. Een andere mogelijkheid
bestaat erin de expressie van weefseltypische antigenen
door genetische manipulatie te veranderen of te blokkeren. (klik op het plaatje voor een vergroting.) Eventueel zou op die manier een universele donorstamcel
kunnen worden gecreëerd. Wanneer de patiënt zijn
eigen stamcellen toegediend kan krijgen, doet dit
probleem zich natuurlijk niet voor. Maar omwille van de
geringe proliferatiemogelijkheden vormen AS voorlopig
geen volwaardig alternatief. Daarnaast lijken de differentiatierichtingen veel beperkter en zijn geprepareerde fracties
zelden zuiver. Veilig gebruik van AS impliceert de
aanmaak van zuivere cellijnen door klonen. Dat geldt
niet voor de hemapoetische componenten uit het beenmerg,
die voor transplantatie bruikbaar zijn omdat ze in
het lichaam van de ontvanger hun reguliere functie mogen uitoefenen. De
aanwezigheid van AS in alle organen staat trouwens
nog altijd ter discussie, ondermeer wat de pancreas
betreft. Hier dient de Dolly aanpak zich als mogelijke
oplossing aan. Om het tekort op te lossen probeerden
onderzoekers door middel van kerntransplantatie embryonale
stamcellen te maken uit lichaamscellen van patienten.
Veel moeten we daar voorlopig niet van verwachten.
Gezien de geringe steun die momenteel te vinden is
voor het gebruik van ten dode opgeschreven menselijke
restembryo's, zal het aanmaken van embryo;s voor het
genezen van zieke organen, het zogenamde therapeutisch
klonen, nog wel een tijdlang in de koelkast blijven.
Het klonen van het eerste menselijke embryo voor onderzoeksdoeleinden
belooft de controverse in de Verenigde Staten weer
te doen losbarsten. De recente prestatie van Advanced
Cell Technology Inc (ACT) zou het witte huis er wel
eens toe kunnen aanzetten ook de private onderzoeksinitiatieven
aan banden te leggen.
 Bij
een hartaanval blijft een deel van de hartspiercellen
verstoken van zuustofrijkbloed en sterft het af. Tot
nu toe zijn er geen bewijzen van de aanwezigheid van
adulte stamcellen in het hart en als ze er toch zitten,
dan doen ze weing om de schade te repareren. (klik
op het plaatje voor een vergroting.) Littekenweefsel
komt in de plaats van de afgestorven cellen waardoor
het hart verzwakt. Pogingen om zulke letsels bij muizen
door het transplanteren van gedifferentieerde hartspiercellen
te herstellen, mislukten. Gelijkwaardige experimenten
waarbij hematopoetische stamcellen uit het beenmerg
in de ventrikelrand werden ingespoten, leidden wet
tot regeneratie van de hartspier. Een ander studie
toonde aan dat de pompfunctie ook herstelt wanneer
de stamcellen in het beenmerg worden ingeplant, wat
suggereerd dat ze op eigen houtje de weg vinden naar
de hartspier. Ook met menselijke stamcellen werden
bescheiden successen geboekt. In vitro bleken hes
te differentieren tot contractiele cellen die die
specifieke 'hartmerkers', oppervlaktemoleculen die
typisch op het membraan van de hartspieren tot expressie
komen, vertoonden.
Bij
een hartaanval blijft een deel van de hartspiercellen
verstoken van zuustofrijkbloed en sterft het af. Tot
nu toe zijn er geen bewijzen van de aanwezigheid van
adulte stamcellen in het hart en als ze er toch zitten,
dan doen ze weing om de schade te repareren. (klik
op het plaatje voor een vergroting.) Littekenweefsel
komt in de plaats van de afgestorven cellen waardoor
het hart verzwakt. Pogingen om zulke letsels bij muizen
door het transplanteren van gedifferentieerde hartspiercellen
te herstellen, mislukten. Gelijkwaardige experimenten
waarbij hematopoetische stamcellen uit het beenmerg
in de ventrikelrand werden ingespoten, leidden wet
tot regeneratie van de hartspier. Een ander studie
toonde aan dat de pompfunctie ook herstelt wanneer
de stamcellen in het beenmerg worden ingeplant, wat
suggereerd dat ze op eigen houtje de weg vinden naar
de hartspier. Ook met menselijke stamcellen werden
bescheiden successen geboekt. In vitro bleken hes
te differentieren tot contractiele cellen die die
specifieke 'hartmerkers', oppervlaktemoleculen die
typisch op het membraan van de hartspieren tot expressie
komen, vertoonden.
Dr. Christine Mummery van het Hubrecht laboratorium
in Utrecht leidt een van de onderzoeksgroepen die
zich op dit soort experimenten toeleggen. Wanneer
artsen de eerste infarctpatienten zullen kunnen behandelen,
durft ze niet voorspellen. We kunnen al met enige
regelmaat hes tot kloppende hartcelllen laten differentieren,
maar we weten nog niet met welke soorten we precies
te doen hebben. Zijn het atriumcellen, ventrikelcellen
of pacemakerecellen? Daarna gaan we opzoek om grotere
aantallen cellen te kweken en moeten we de celmengsels
nog verder kunnen zuiveren. In maart 2001 durfden
cardiologen van de universiteit van Dusseldorf het
toch al aan een hartpatient te behandelen, weliswaar
niet met embryonale stamcellen maar met volwassen
stamcellen uit zijn eigen beenmerg. De hartspier van
de man was ernstig beschadigd aan het linkerventrikel.
Tien weken na de behandeling zou de pompfunctie verbeterd
zijn en het letsel aanzienlijk gekrompen. De resultaten
stuiten op heel wat scepsis van collega-onderzoekers.
Ze vinden het onverantwoord op basis van enkele experimenten
met muizen meteen een mens als proefkonijn te gaan
gebruiken. Andere onderzoeksgroepen slagen er momenteel
zelfs ter nauwernood in de resultaten van de laboratoriumtest
op muizen succevol te herhalen.
Wetenschappers
vragen meer
Als de nood het hoogst is, toont de mens zich het creatiefst.
Amerikaanse onderzoekscentra, waanonder ook ACT, zijn
druk doende met het creeren van niet levensvatbare menselijke
embryo's uit onbevruchte eicellen. Die kunnen welliswaar
stamcellen produceren,. maar nooit uitgroeien tot tot
een volwaardig mensenkind. Een bijzonder gehaaide poging
om de ethici een stapje voor te zijn. Met muizen en
apen schijnt het alvast te lukken. Onderzoekers van
de PPL therapeutict of Blacksburg Verginia gaan nog
verder. Zij zijn er naar eigen zeggen al in geslaagd
de huidcellen van een volwassen koe te herprogrammeren
tot stamcellen, die ze dan opnieuw lieten uitdifferentieren
tot pulserende hartcellen. En dat zonder dat er ook
maar een embryo, levensvatbaar of niet, aan te pas moest
komen.
De
wetenschap mag sowieso haar volledige kapitaal niet
op het therapeutisch klonen verwedden en moet investeren
in andere mogelijkheden om het afstotingsprobleem te
tackelen. Het gebruik van eigen cellen is immers niet
altijd aan te bevelen. Denk maar aan erfelijke ziektes
zoals sommige vormen van leukemie, waarbij het defect
in de genen van de eigen cellen ingebakken zit. Het
team van diezelfde dr. Thomson die in 1998 de wereld
verblijde met de eerste humane ES, rapporteerde onlangs
over een andere manier om het afstoting probleem te
omzeilen. We weten al langer dat de mensen die een volledige
beenmergtransplantatie hebben ondergaan geen afstotingsreactie
meer vertonen tegen organen afkomstig van dezelfde donor.
Dat is niets om verwonderd over te zijn, aangezien de
immuuncellen van de patient afgeleid zijn van het gedoneerde
beenmerg. Volgens dit zelfde principe hopen de onderzoekers
door stamceltransplantatie tolerantie op te wekken tegenover
organen die buiten het lichaam op basis van dezelfde
stamcellen werden gemaakt.
Nog
naar weinig laboratoria beschikken over humane stamcellen.
De vierenzestig door het NIH erkende stamcellijnen gaan
momenteel de hele wereld rond. Het Hubrecht laboratorium
in Utrecht werkt bijvoorbeeld met Australische cellen.
Om het onderzoek verder te zetten, vragen de wetenschappers
toestemming de duizenden restembryo's in de vrieskasten,
die zowieso ten dode zijn opgeschreven, te mogen gebruiken
om nieuwe ES in cultuur te brengen. In Nederland keurde
onlangs de Tweede Kamer de embryowet goed. Als nu ook
de Eerste Kamer haar ja woord geeft, verliezen de diepgevroren
restembryo's hun status van verboden vrucht en kunnen
de nederlandse universiteiten met eigen stamcelculturen
van start gaan. Therapeutisch klonen, het aanmaken specifiek
voor dit doel van embryo's mag voorlopig niet.
De
embryowet laat wel een opening om het debat in de
toekomst, wanneer wat meer duidelijkheid bestaat rond
eventuele risico's en tegenwerpingen, opnieuw op te
starten. In Belgie zou therapeutisch klonen vandaag
wat minder problemen opleveren, niet omdat de wetgever
zo vooruitstrevend is, maar omdat van enige wet voorlopig
nog geen sprake is. De bijzondere commissie van bio-ethische
problemen belooft er binnenkort de schouders onder
te zetten wegens meer dan hoogdringend. Het onderzoek
vordert immers snel. De kaarten liggen over een aantal
maanden misschien helemaal anders. Ook blijft hij
voorlopig bescheiden, over de stamcel is het laatste
woord voorlopig nog lang niet gezegd.
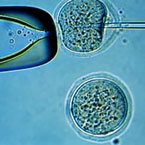
 Ongedifferentieerde
stamcellen uit het laboratorium van James Thomson.
De stamcellen zijn de grote ronde cellen. De langwerpige
cellen tussen de stamcellen in zijn zogenaamde 'feeder'-cellen
waarop de stamcellen groeien.
Ongedifferentieerde
stamcellen uit het laboratorium van James Thomson.
De stamcellen zijn de grote ronde cellen. De langwerpige
cellen tussen de stamcellen in zijn zogenaamde 'feeder'-cellen
waarop de stamcellen groeien.
Artikel:
eos magazine Januari 2002

 In
de Verenigde staten, de bakermat van het stamcelonderzoek,
leek het er zelfs even alsof op dat president Bush de tegenstanders
hun zin wilde geven en de universiteiten geen rechten meer te verlenen. De medische wereld ging in het verweer met
een nog nooit eerder vertoond media-offensief. Ook de
Europese pers liet zich niet onbetuigd. Kranten en tijdschriften
overspoelden ons met veelbelovende resultaten, nieuwe
ontdekkingen en geslaagde experimenten. Op 9 augustus
2001 volgde een zucht van verlichting: Bush toonde zich
bereid verder onderzoek op bestaande stamcellijnen -
over de hele wereld zijn er vierenzestig erkend door
de Amerikaanse National institutes of Health - met belastinggeld te sponsoren. "De keuze tussen leven en dood is
daar al genomen", verantwoordde de president zijn beslissing.
Van in- vitro fertilisatie overgebleven embryo's gebruiken
om er vers materiaal uit te "oogsten" was
daarentegen ging brug te ver en het actief creëren van
embryo's voor onderzoek botste al helemaal op een presidentieel
"no". Ondanks het achterpoortje - het verbod
geldt alleen voor onderzoek dat wordt gefinancierd met
overheidsgeld - reageerden tal van wetenschappers ontgoocheld.
Het razende tempo waarmee de puzzelstukjes worden blootgelegd,
geeft velen de indruk dat het onderzoek vergevorderd
is. Maar wanneer stamcellen hun therapeutische beloften
kunnen inlossen, is nog veel onderzoek nodig, heel veel
onderzoek. En daar hoort bijgevolg ook nog heel veel onderzoeksmateriaal bij.
In
de Verenigde staten, de bakermat van het stamcelonderzoek,
leek het er zelfs even alsof op dat president Bush de tegenstanders
hun zin wilde geven en de universiteiten geen rechten meer te verlenen. De medische wereld ging in het verweer met
een nog nooit eerder vertoond media-offensief. Ook de
Europese pers liet zich niet onbetuigd. Kranten en tijdschriften
overspoelden ons met veelbelovende resultaten, nieuwe
ontdekkingen en geslaagde experimenten. Op 9 augustus
2001 volgde een zucht van verlichting: Bush toonde zich
bereid verder onderzoek op bestaande stamcellijnen -
over de hele wereld zijn er vierenzestig erkend door
de Amerikaanse National institutes of Health - met belastinggeld te sponsoren. "De keuze tussen leven en dood is
daar al genomen", verantwoordde de president zijn beslissing.
Van in- vitro fertilisatie overgebleven embryo's gebruiken
om er vers materiaal uit te "oogsten" was
daarentegen ging brug te ver en het actief creëren van
embryo's voor onderzoek botste al helemaal op een presidentieel
"no". Ondanks het achterpoortje - het verbod
geldt alleen voor onderzoek dat wordt gefinancierd met
overheidsgeld - reageerden tal van wetenschappers ontgoocheld.
Het razende tempo waarmee de puzzelstukjes worden blootgelegd,
geeft velen de indruk dat het onderzoek vergevorderd
is. Maar wanneer stamcellen hun therapeutische beloften
kunnen inlossen, is nog veel onderzoek nodig, heel veel
onderzoek. En daar hoort bijgevolg ook nog heel veel onderzoeksmateriaal bij. Een
gedifferentieerde cel vermenigvuldigt zich zelden of
niet. Wanneer een orgaan door ziekte of ongeval beschadigd
raakt, kunnen gespecialiseerde lichaamscellen het dode
of aangetaste weefsel niet goed vervangen. Dat brengt
ons bij de tweede bijzondere eigenschap. Stamcellen
kunnen praktisch onbeperkt dochtercellen vormen of "prolifereren".
Bij elke deling zal minstens één cel een nieuwe stamcel
zijn, zodat het voortbestaan is verzekerd. Met andere woorden: stamcellen
kunnen zichzelf met andere woorden vernieuwen. De tweede
dochtercel kan een partieel gedifferentieerde voorlopercel
zijn, die via een reeks delingsstappen tot specifieke
celtypes zal leiden. Daarna valt het delen stil. Proliferatie
en differentiatie zijn het begin- en eindpunt van een
proces dat van een stamcel tot lichaamcel leidt.
Een
gedifferentieerde cel vermenigvuldigt zich zelden of
niet. Wanneer een orgaan door ziekte of ongeval beschadigd
raakt, kunnen gespecialiseerde lichaamscellen het dode
of aangetaste weefsel niet goed vervangen. Dat brengt
ons bij de tweede bijzondere eigenschap. Stamcellen
kunnen praktisch onbeperkt dochtercellen vormen of "prolifereren".
Bij elke deling zal minstens één cel een nieuwe stamcel
zijn, zodat het voortbestaan is verzekerd. Met andere woorden: stamcellen
kunnen zichzelf met andere woorden vernieuwen. De tweede
dochtercel kan een partieel gedifferentieerde voorlopercel
zijn, die via een reeks delingsstappen tot specifieke
celtypes zal leiden. Daarna valt het delen stil. Proliferatie
en differentiatie zijn het begin- en eindpunt van een
proces dat van een stamcel tot lichaamcel leidt.  Inmiddels
leverden onderzoekers de bewijzen dat humane ES zich
net, als de ES uit muizen, kunnen differentiëren tot
gespecialiseerde cellen van zowel ecto-, endo- als mesodermale
oorsprong (de drie kiembladen) , een eigenschap die
doorgaans wordt aangeduid als pluripotentie. Wanneer
hes in de testes van laboratoriummuizen worden geïnjecteerd,
groeien ze uit tot teratoma's, goedaardige gezwellen
die de meest diverse weefsels bevatten, zoals (kraak)been,
spiercellen, neuronen, bloedvaten en zelfs tandweefsel
of haren, wat een vrij grotesk amalgaam oplevert. Ook
in vitro differentiëren de hes - na verwijdering van
de speciale "voedercellen" die proliferatie
in laboratoriumomstandigheden gaande houden - spontaan
uit tot meerdere weefseltypes.
Inmiddels
leverden onderzoekers de bewijzen dat humane ES zich
net, als de ES uit muizen, kunnen differentiëren tot
gespecialiseerde cellen van zowel ecto-, endo- als mesodermale
oorsprong (de drie kiembladen) , een eigenschap die
doorgaans wordt aangeduid als pluripotentie. Wanneer
hes in de testes van laboratoriummuizen worden geïnjecteerd,
groeien ze uit tot teratoma's, goedaardige gezwellen
die de meest diverse weefsels bevatten, zoals (kraak)been,
spiercellen, neuronen, bloedvaten en zelfs tandweefsel
of haren, wat een vrij grotesk amalgaam oplevert. Ook
in vitro differentiëren de hes - na verwijdering van
de speciale "voedercellen" die proliferatie
in laboratoriumomstandigheden gaande houden - spontaan
uit tot meerdere weefseltypes.  over de ethische
implicaties van het onderzoek als over de bevindingen
van de wetenschappers zelf. Het idee dat de wetenschap
beginnend menselijk leven uit elkaar peutert alsof
het kikkerdril was,bezorgt heel wat mensen acute buikpijn.Het debat wordt dan ook gevoerd op het scherp van de
snede.Nu blijkt dat ook volwassen mensen in vrijwel
elk orgaan een voorraadje stamcellen hebben,
gaan meer en meer stemmen op om het onderzoek toe te
splitsen op de zogenaamde adulte stamcellen of AS.
over de ethische
implicaties van het onderzoek als over de bevindingen
van de wetenschappers zelf. Het idee dat de wetenschap
beginnend menselijk leven uit elkaar peutert alsof
het kikkerdril was,bezorgt heel wat mensen acute buikpijn.Het debat wordt dan ook gevoerd op het scherp van de
snede.Nu blijkt dat ook volwassen mensen in vrijwel
elk orgaan een voorraadje stamcellen hebben,
gaan meer en meer stemmen op om het onderzoek toe te
splitsen op de zogenaamde adulte stamcellen of AS.
 Stamcellen
migreren uit zichzelf naar de plaats waar hun hulp
nodig is. Ze drijven met de bloedstroom mee en "leggen
aan" op die plaatsen in het lichaam waar ze receptoren
vinden voor de specifieke moleculen in hun celmembraan.
Voorlopig moeten we nog raden naar de exacte identiteit
van de factoren die dit proces besturen of beïnvloeden.
Overigens, ook bij beenmergtransplantaties wordt het
bloed gewoon via een infuus toegediend en zoekt
het zelf zijn weg naar het beenmerg.
Stamcellen
migreren uit zichzelf naar de plaats waar hun hulp
nodig is. Ze drijven met de bloedstroom mee en "leggen
aan" op die plaatsen in het lichaam waar ze receptoren
vinden voor de specifieke moleculen in hun celmembraan.
Voorlopig moeten we nog raden naar de exacte identiteit
van de factoren die dit proces besturen of beïnvloeden.
Overigens, ook bij beenmergtransplantaties wordt het
bloed gewoon via een infuus toegediend en zoekt
het zelf zijn weg naar het beenmerg.
 Het
stimuleren van een complexe motorischeaandoening als
amyotrofische laterale sclerose (ALS), gebeurt door
besmetting met het sindbisvirus dat de motorische voorhoorncellen
in het ruggenmerg vernietigt en de karakteristieke verlammingsverschijnselen
veroorzaakt. Beide toestanden werden al succesvol met
stamcelinjecties behandeld. Ook voor de ziekte van Parkinson
en diabetes mellitus geven proefdierexperimenten hoop op beterschap.
De verworven resultaten zijn op zich wel betekenisvol,
maar mogen niet zomaar naar de mens worden geëxtrapoleerd. Zelfs als de stamcellen uiteindelijk niet aan
al die hooggespannen verwachtingen voor menselijk therapeutisch
gebruik tegemoet kunnen komen, dan nog zullen ze een
aanzienlijke bijdrage kunnen leveren aan het wetenschappelijk
onderzoek. Stamcellen bieden de mogelijkheid het effect
van nieuwe geneesmiddelen rechtstreeks op de doelwitcellen
aan te tonen en om inzicht te verwerven in de verborgen
processen die leiden tot differentiatie en dedifferentiatie
van cellen. Misschien levert dit soort onderzoek uiteindelijk
therapieën op voor tal van aangeboren aandoeningen.
Zo wilde dr. Gearhart niet zozeer de eerste zijn om
stamcellen te kweken uit primordiale kiemcellen, maar
was hij op zoek naar een geschikt instrument om het
syndroom van Down te bestuderen.
Het
stimuleren van een complexe motorischeaandoening als
amyotrofische laterale sclerose (ALS), gebeurt door
besmetting met het sindbisvirus dat de motorische voorhoorncellen
in het ruggenmerg vernietigt en de karakteristieke verlammingsverschijnselen
veroorzaakt. Beide toestanden werden al succesvol met
stamcelinjecties behandeld. Ook voor de ziekte van Parkinson
en diabetes mellitus geven proefdierexperimenten hoop op beterschap.
De verworven resultaten zijn op zich wel betekenisvol,
maar mogen niet zomaar naar de mens worden geëxtrapoleerd. Zelfs als de stamcellen uiteindelijk niet aan
al die hooggespannen verwachtingen voor menselijk therapeutisch
gebruik tegemoet kunnen komen, dan nog zullen ze een
aanzienlijke bijdrage kunnen leveren aan het wetenschappelijk
onderzoek. Stamcellen bieden de mogelijkheid het effect
van nieuwe geneesmiddelen rechtstreeks op de doelwitcellen
aan te tonen en om inzicht te verwerven in de verborgen
processen die leiden tot differentiatie en dedifferentiatie
van cellen. Misschien levert dit soort onderzoek uiteindelijk
therapieën op voor tal van aangeboren aandoeningen.
Zo wilde dr. Gearhart niet zozeer de eerste zijn om
stamcellen te kweken uit primordiale kiemcellen, maar
was hij op zoek naar een geschikt instrument om het
syndroom van Down te bestuderen.

